TFOS DEWS II - Rapport Définition et classification
Jennifer P. Craig, MCOptom, PhD1, Kelly K. Nichols, OD, PhD1, Esen K. Akpek, MD, Barbara Caffery, OD, PhD, Harminder S. Dua, MD, PhD, Choun-Ki Joo, MD, PhD, Zuguo Liu, MD, PhD, J. Daniel Nelson, MD, Jason J. Nichols, OD, PhD, Kazuo Tsubota, MD, PhD, Fiona Stapleton, MCOptom, PhD
Translated into French by Allergan
| Téléchargez cette section en format PDF |
RESUME
Les objectifs de la sous-commission Définition et classification du DEWS II de la TFOS étaient de créer un système de classification actuel et de définition fondée sur des preuves pour le syndrome sec oculaire (SSO). La nouvelle définition reconnaît la nature multifactorielle du syndrome sec oculaire en tant que maladie dans le cas où la perte du film lacrymal est le concept physiopathologique central. Il a été décidé qu’il était important d’inclure dans cette définition le terme plus large de symptômes oculaires, qui recouvre les signalements de gêne ou de perturbation visuelle, de même que les étiologies principales d’instabilité et d’hyperosmolarité du film lacrymal, ainsi que l’inflammation et les lésions de la surface oculaire. À la lumière des nouvelles données, les anomalies neurosensorielles ont elles aussi été ajoutées pour la première fois à cette définition. Dans la classification du SSO, des preuves récentes ont permis d’établir un système de classification basé sur sa physiopathologie dans lequel le syndrome sec oculaire par déficience aqueuse et le syndrome sec oculaire évaporatif existent à l’intérieur d’un continuum. C’est pourquoi les éléments de chacun d’eux doivent être pris en considération pour le diagnostic et la prise en charge. Un diagnostic positif de SSO avec des signes et des symptômes est l’élément central de ce système. Le but va être une prise en charge pour restaurer l’homéostasie. Le système permet également de prendre en considération différentes manifestations apparentées telles que des maladies non évidentes impliquant des signes de surface oculaire sans symptômes associés, des maladies neurotrophiques dans lesquelles une sensation de dysfonctionnement existe et des cas dans lesquels des symptômes existent sans signes démontrables sur la surface oculaire, y compris des douleurs neuropathiques. Cette approche n’est pas destinée à remplacer une évaluation et un jugement cliniques, mais devrait aider à guider la prise en charge clinique et la recherche.
Mots clés : Déficience aqueuse, Classification, Définition, Syndrome de l’œil sec, Évaporatif, Mécanisme
1. Introduction reviens
Au cours des trente dernières années, il y a eu une sensibilisation considérable dans le monde pour le syndrome sec oculaire (SSO). Grâce aux efforts conjugués de nombreux organismes, nous avons beaucoup appris sur l’origine et l’impact de cette maladie en vue d’améliorer les soins cliniques destinés aux individus atteints. La sous-commission Définition et classification est parvenue à une définition fondée sur des preuves et révisée pour la sécheresse oculaire et à un système de classification cohérent avec la compréhension actuelle du SSO. Les définitions et systèmes de classification antérieurs de la sécheresse oculaire ont servi de point de départ. Des modifications ont été apportées pour pallier les manques perçus, à partir de la littérature actuelle et en parvenant à un consensus à partir des réponses et des opinions des membres du DEWS II de la TFOS. Reconnaissant l’importance d’un consensus mondial sur la sécheresse oculaire, la commission Définition et classification, avec les contributions des membres du DEWS II de la TFOS qui représentent 23 pays, a fait tout son possible pour trouver une définition traduisible et universellement compréhensible.
Même si des progrès dans la littérature clinique, translationnelle et de science fondamentale actuelle ont permis de clarifier les facteurs qui caractérisent et apportent leur contribution à la sécheresse oculaire, de nombreuses questions demeurent sans réponse. Ce rapport présente une définition mondiale actualisée de la sécheresse oculaire et un système de classification conçu pour faciliter la prise en charge clinique de la sécheresse oculaire d’après les caractéristiques rencontrées. Ce rapport reconnaît encore les principaux sous-types étiologiques de la sécheresse oculaire comme la forme par déficience aqueuse et la forme évaporative, mais admet la coexistence fréquente et le chevauchement des sous-types. Le système de classification révisé dirige le lecteur, lorsqu’il considère les éléments étiologiques susceptibles d’être impliqués, vers le rapport Physiopathologie du DEWS II de la TFOS, dans lequel ces éléments sont décrits plus en détail [1].
2. Objectifs de la sous-commission Définition et classification reviens
Les objectifs de la sous-commission Définition et classification du DEWS II de la TFOS étaient de créer un système de classification actuel et de définition fondée sur des preuves pour le SSO.
3. Aperçu historique de la sécheresse oculaire reviens
L’examen de l’historique existant derrière notre compréhension de la sécheresse oculaire nous aide à placer dans son contexte cette définition révisée la plus récente du SSO. La sécheresse oculaire a été définie officiellement comme un état maladif il y a seulement un peu plus de 30 ans. Vers le milieu des années 1990, la compréhension de la sécheresse oculaire a atteint un point critique, qui a permis un développement rapide et précis. La première définition de la sécheresse oculaire, publiée en 1995 d’après un consensus obtenu à partir du groupe de travail NEI (Institut américain de l’œil)/industrie s’appuyant sur des essais cliniques menés sur la sécheresse oculaire, était la suivante [2].
« La sécheresse oculaire est un trouble du film lacrymal dû à une déficience en larmes ou à une évaporation excessive des larmes, qui provoque une lésion sur la surface oculaire interpalpébrale, et est associée à des symptômes de gêne oculaire. »
Il est important de noter que cette première définition désignait le rôle de la qualité du film lacrymal et de la quantité de larmes comme cause de la sécheresse oculaire.
Pour beaucoup, la définition et le rapport de 1995 offraient un schéma directeur pour la recherche clinique, translationnelle et fondamentale, permettant une avancée du domaine. Il convient de noter que la définition utilisait le terme de « trouble » et non de « maladie ».
D’une manière similaire, en 2006, un groupe de consensus utilisant la méthode de Delphi a proposé un nouveau nom pour le SSO, afin de refléter l’importance de la qualité et de la quantité de larmes, à savoir « le syndrome des larmes dysfonctionnelles ». Un système de classification a été créé de la même manière dans le but de guider le traitement d’après la maladie, avec ou sans inflammation prouvée cliniquement [3].
En 2007, la première définition de la sécheresse oculaire par le DEWS de la TFOS a été publiée, après trois ans d’un processus international fondé sur le consensus [4]. Presque 10 ans après la publication du premier rapport NEI/industrie, des avancées significatives ont été réalisées dans la compréhension de la sécheresse oculaire. La littérature de plus en plus abondante et l’accent mis sur les approches diagnostique et thérapeutique ont conduit à une définition révisée, centrée sur les effets cliniques et les signes associés [4].
« La sécheresse oculaire est une maladie multifactorielle des larmes et de la surface oculaire qui se traduit par des symptômes de gêne, de perturbation visuelle, d’instabilité du film lacrymal et des lésions potentielles de la surface oculaire. Elle s’accompagne d’une augmentation de l’osmolarité du film lacrymal et d’une inflammation de la surface oculaire. »
Le groupe de travail initial DEWS de la TFOS a été le premier à reconnaître la sécheresse oculaire comme une maladie à part entière, avec une étiologie multifactorielle. Une fois encore, les symptômes étaient reconnus comme fondamentaux, mais comprenaient non seulement les symptômes de gêne, mais aussi les symptômes de perturbation visuelle transitoire. Même si les séquelles de la sécheresse oculaire étaient décrites en matière de symptômes et d’instabilité du film lacrymal et si l’augmentation de l’osmolarité du film lacrymal et l’inflammation étaient citées comme associées à la maladie, le rapport ne contenait pas d’énoncé concernant le mécanisme ou l’étiologie du SSO. Plus précisément, l’augmentation de l’osmolarité et l’inflammation étaient décrites comme temporaires et non comme des marqueurs de la maladie.
4. Définition de la sécheresse oculaire reviens
4.1. Considérations importantes
À la suite des discussions préliminaires de la sous-commission, une enquête a été menée fin 2015 auprès des membres du DEWS II de la TFOS, demandant spécifiquement si la définition originelle du DEWS était acceptable et devait rester la définition du DEWS II. Parmi les personnes interrogées, 77 % ont voté en faveur d’un changement de la définition. Dans un questionnaire à choix de réponse, les propositions correspondaient à une définition simplifiée ou à une version tronquée de la définition d’origine du DEWS. Toutefois, près de deux tiers des membres ont ajouté des commentaires en faisant part de préoccupations spécifiques.
Plus précisément, il est apparu que les membres du DEWS II de la TFOS reconnaissaient le rôle significatif de l’inflammation et de l’hyperosmolarité dans le SSO, mais contestaient la présence de ces termes précis dans la définition, car ils pensaient que ces caractéristiques physiopathologiques devaient être démontrées cliniquement pour valider un diagnostic de sécheresse oculaire. Pour traiter ce problème et d’autres préoccupations, un groupe de représentants de la sous-commission Définition et Classification – la commission Harmonisation et le comité directeur – s’est réuni en décembre 2016 à Saint Paul, dans le Minnesota (États-Unis), pour procéder à l’examen de l’ensemble des rapports du DEWS II de la TFOS, afin de finaliser la définition proposée par la sous-commission Définition et Classification.
De nombreux points critiques ont été discutés, y compris la reconnaissance du fait qu’une perte de l’homéostasie du film lacrymal peut résulter d’une multitude de facteurs englobant les anomalies de la paupière et du clignement, en plus des déficiences de la surface oculaire ou des composants lacrymaux [1, 5]. Ces changements peuvent induire une instabilité localisée ou globale du film lacrymal et une hyperosmolarité lacrymale en réponse à une évaporation excessive de la surface oculaire. Ils sont considérés comme des points de départ importants contribuant à la pathogenèse et à la poursuite d’un cycle d’événements ou « cercle vicieux » dans le SSO [4, 6, 7]. Comme la caractérisation des interactions précises entre cette surface oculaire complexe et l’environnement du film lacrymal est difficile, il était jugé souhaitable d’inclure à la fois le résultat attendu de la maladie (une perturbation mesurable cliniquement de l’homéostasie du film lacrymal) et de souligner les éléments étiologiques clés dans la définition). Les éléments étiologiques sont importants pour optimiser la spécificité de la définition de la sécheresse oculaire, afin de la différencier des autres maladies de la surface oculaire. L’étendue des changements potentiels susceptibles de survenir dans le cadre du déséquilibre homéostatique offre au clinicien, au chercheur, au représentant de l’industrie et/ou à l’organisme de réglementation, la liberté de choisir les caractéristiques les plus appropriées comme mesures de résultats en accord avec l’étiologie spécifique de la sécheresse oculaire étudiée. Élaborer une définition et une classification avec une interprétation suffisamment large pour permettre son évolution et sa flexibilité dans le domaine de la recherche consacrée à la sécheresse oculaire est resté prioritaire pendant l’ensemble du processus d’élaboration de la définition.
Au cours des dix dernières années, des preuves de plus en plus nombreuses du rôle potentiel des anomalies neurosensorielles ont été mises en évidence dans la compréhension et la prise en charge du SSO. La douleur neuropathique résulte d’une lésion au sein du système nerveux somato-sensoriel, ce qui la différencie du SSO. La douleur nociceptive survient en réponse à une lésion tissulaire locale. Les nocicepteurs cornéens, qui transmettent les informations somato-sensorielles de « douleur » au système nerveux central peuvent être sensibilisés par une stimulation physiologique répétée ou par des stimuli nuisibles (p. ex. hyperosmolarité ou inflammation) [8]. Même si nous ne comprenons pas encore parfaitement le rôle exact joué par les anomalies neurosensorielles dans les voies physiopathologiques du SSO, leur potentiel doit être reconnu en attendant l’élucidation de leur rôle grâce à de nouvelles études.
4.2. Considérations complémentaires pour la définition
D’un point de vue clinique, la sécheresse oculaire est souvent décrite comme « chronique » et « progressive », même s’il manque actuellement des preuves permettant d’ajouter ces termes à la définition. Même si l’omission de ces termes de la définition est justifiée actuellement, de nouvelles recherches – notamment à propos de l’histoire naturelle de la sécheresse oculaire – doivent être effectuées pour affiner la terminologie de la définition
4.3. Définition révisée du DEWS II de la TFOS
Par conséquent, en résumé, les membres du DEWS II de la TFOS, d’après les preuves actuelles, ont reconnu le fait que cette définition devait reconnaître la nature multifactorielle du SSO, et tous s’accordent à dire que l’élément unificateur du SSO est la perte d’homéostasie du film lacrymal. Les symptômes oculaires, qui comprennent la gêne ou la perturbation visuelle, ou les deux, restent une caractéristique centrale de la maladie. Exprimer les rôles étiologiques clés de l’instabilité, de l’hyperosmolarité du film lacrymal, de l’inflammation et des lésions de la surface oculaire était important pour la reconnaissance du processus cyclique de la maladie, avec ses différents points de départ, comme le décrivent les rapports Physiopathologie et Film lacrymal [1, 5]. À la lumière de la littérature toujours plus fournie dans ce domaine, il semblait également important de reconnaître dans la définition, le rôle joué par les anomalies neurosensorielles dans l’étiologie de la maladie [8].
Ce processus a conduit à la définition mondiale affinée de la sécheresse oculaire par le DEWS II de la TFOS, que voici :
« La sécheresse oculaire est une maladie multifactorielle de la surface oculaire caractérisée par une perte de l’homéostasie du film lacrymal et accompagnée de symptômes oculaires, dans laquelle l’instabilité et l’hyperosmolarité du film lacrymal, l’inflammation et les lésions de la surface oculaire ainsi que des anomalies neurosensorielles jouent des rôles étiologiques. »
5. Description des termes reviens
La terminologie utilisée dans la définition, y compris la diction, l’ordre des mots, l’insistance et la signification convenue, était essentielle pour créer une définition acceptée dans le monde entier qui se prête à la traduction dans de nombreuses langues. Les termes sont définis à leur tour individuellement.
5.1. Multifactorielle
Le rapport du DEWS de 2007 a reconnu la sécheresse oculaire comme une maladie multifactorielle complexe qui ne peut pas être caractérisée par un processus, un signe ou un symptôme unique. D’un point de vue médical, le terme « multifactoriel » signifie ayant ou découlant de nombreuses causes ou influences différentes en interaction, comme dans le cas du SSO.
5.2. Maladie
Depuis 2007, la définition reconnaît la sécheresse oculaire en tant que maladie. Même si les définitions de « maladie » varient, il est généralement entendu qu’il s’agit d’un trouble de la structure ou de la fonction ou d’un état maladif qui se traduit par des signes ou symptômes spécifiques. Du point de vue des soins aux patients et pour fournir une appréciation générale de la sécheresse oculaire en tant qu’entité associée à des conséquences pathologiques et de qualité de vie, il a été jugé important de conserver le terme « maladie » dans la définition [9].
5.3. Surface oculaire
Pour les besoins de cette définition, en adéquation avec les rapports antérieurs de la TFOS [4, 10, 11], la surface oculaire est définie comme comprenant les structures de l’œil et les annexes, y compris la cornée, la conjonctive, les paupières, les cils, le film lacrymal, les glandes lacrymales principales et auxiliaires ainsi que les glandes de Meibomius. C’est pourquoi les larmes, à la fois en tant que composants individuels au niveau du site de production et en tant que film sur la surface oculaire, sont incluses dans le terme « surface oculaire ».
5.4. Homéostasie du film lacrymal
Le film lacrymal joue un rôle vital en assurant la lubrification et la protection de la surface oculaire, ainsi que le maintien d’une surface lisse et réfractive pour des performances visuelles optimales [5]. D’un point de vue physiologique, l’homéostasie décrit l’état d’équilibre dans le corps par rapport à ses différentes fonctions et à la composition chimique des liquides organiques et des tissus [12]. Appliqué au SSO, le concept de perturbation de l’homéostasie du film lacrymal reconnaît la possibilité de survenue possible de nombreux changements différents dans le film lacrymal et la surface oculaire [5], en réponse à une ou plusieurs causes sous-jacentes de sécheresse oculaire [1]. La perturbation de l’homéostasie est considérée comme la caractéristique unificatrice décrivant le processus fondamental dans le développement du SSO.
5.5. Symptômes
La définition de 1995 de la sécheresse oculaire identifiait la gêne comme la principale réponse symptomatique associée à la sécheresse oculaire [2] et la définition de 2007 a élargi la notion des symptômes pour intégrer la perturbation visuelle. Comme la terminologie varie d’une langue et d’une culture à l’autre, par exemple, les expressions « sable dans les yeux » et « picotement des yeux » ne sont pas souvent rapportées ni bien comprises en mandarin [13]. C’est pourquoi l’expression symptômes oculaires reste un élément fondamental de la définition du SSO. Le rapport initial du DEWS de la TFOS conservait la gêne dans la définition, mais étendait le concept des symptômes pour inclure la perturbation visuelle, en reconnaissance de la vision transitoirement brouillée rapportée par des individus affectés, qui correspondait à une perte de qualité de la surface lacrymale [4]. Le DEWS II de la TFOS admet que les symptômes de gêne et de perturbation visuelle restent fondamentaux pour le SSO, mais pour éviter des restrictions et optimiser la pertinence dans le monde, la phrase suivante « (…) accompagnée de symptômes oculaires »a été choisie pour la définition actuelle, afin d’englober une gamme plus large de symptômes possibles associés au SSO.
5.6. Rôle étiologique
L’expression « rôle étiologique » souligne le concept d’une voie impliquée, sans suggestion du fait que les caractéristiques spécifiques soient considérées comme des résultats de mesure ou des éléments nécessaires de diagnostic.
6. Systèmes de classification pour le syndrome sec oculaire reviens
6.1. Contexte historique
Les systèmes de classification de la sécheresse oculaire servent à guider le diagnostic et en dernier lieu, à améliorer les soins aux patients grâce à un traitement approprié. Le rapport NEI/industrie (Fig. 1) [2] a identifié les deux catégories principales de sécheresse oculaire comme la forme par déficience aqueuse et la forme évaporative. Une sous-classification y est proposée, avec différents facteurs étiologiques intrinsèques et extrinsèques qui semblent contribuer au développement de la sécheresse oculaire au sein de ces deux catégories.
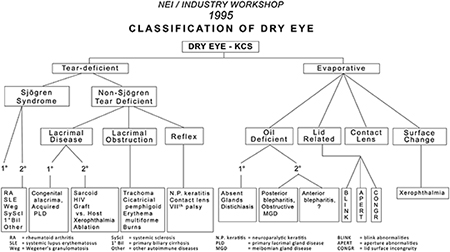
Fig. 1. La classification de la sécheresse oculaire de 1995 [2]. Reproduite avec l’autorisation de Eye & Contact Lens, anciennement CLAO J.
Le système de classification présenté dans le rapport du DEWS de la TFOS (Fig. 2) a conservé les deux catégories principales, par déficience aqueuse et évaporative, même si « par déficience lacrymale » a été redéfini plus précisément en « par déficience aqueuse » [4]. Une fois encore, les étiologies possibles de la maladie ont été présentées sous la forme d’une liste dans un arbre de sous-classification.

Fig. 2. Classification de la sécheresse oculaire d’après le rapport du DEWS de 2007 [4]. Reproduit avec l’autorisation de The Ocular Surface.e.
6.2. Problèmes posés par les systèmes de classification antérieurs
Pendant le déroulement du DEWS II de la TFOS, de nombreuses préoccupations relatives à l’interprétation du système initial de classification du DEWS ont été signalées. La première était liée à la distinction entre les principales catégories de sécheresse oculaire. La coexistence des déficiences à la fois pour la quantité et la qualité des larmes n’est pas rare en raison de la nature cyclique et de l’auto-entretien du SSO. Une fois qu’un individu s’engage dans le « cercle vicieux », quel qu’en soit le point de départ, l’instabilité et l’hyperosmolarité du film lacrymal ainsi que l’inflammation qui s’ensuivent entraînent souvent des changements dommageables supplémentaires, estompant alors la distinction entre les étiologies sous-jacentes des formes par déficience aqueuse et évaporative [1].
Même si un possible chevauchement entre les catégories par déficience aqueuse et évaporative a été reconnu dans le rapport initial du DEWS [4], à la fois dans le texte et la représentation schématique du processus physiopathologique, le système de classification a été perçu par un grand nombre comme porteur d’un sens d’exclusion mutuelle en raison de la description des catégories par déficience aqueuse et évaporative comme deux formes distinctes. Même si les dix dernières années de preuves scientifiques indiquent que la compréhension fondamentale n’a pas évolué radicalement depuis le DEWS, il est apparu important dans le DEWS II de la TFOS, de remédier à l’idée fausse fréquemment associée au système de classification, en s’assurant de la possibilité d’une discussion d’un chevauchement entre ces deux catégories.
Un deuxième problème est apparu, concernant la précision du positionnement de certaines maladies dans la zone de sous-classification du DEWS. L’objectif de l’addition des présentations de sous-catégories concurrentes était d’aider les cliniciens à établir un programme de prise en charge approprié. Toutefois, des preuves récentes suggèrent que de nombreuses maladies pourraient vraisemblablement figurer dans plusieurs rubriques. Par exemple, le syndrome de Sjögren, qui, dans les rapports de 1995 et 2007 [2, 4] a été classifié exclusivement comme résultant d’une déficience aqueuse, a progressivement été reconnu comme possédant simultanément une composante évaporative, en raison du dysfonctionnement des glandes de Meibomius (DGM) associé [14] qui a essentiellement des répercussions sur la fonction lipidique des larmes.
D’autres préoccupations entouraient le niveau de spécificité important dans le diagnostic du SSO pour éviter une erreur de diagnostic par confusion avec d’autres maladies de la surface oculaire. Un tel manque de spécificité dans le diagnostic augmente le risque de sentiment d’échec du traitement, qui conduit non seulement à une déception chez les patients et les cliniciens, mais menace les résultats des essais cliniques et de l’approbation réglementaire de nouvelles thérapies en raison de critères d’inclusion insuffisamment précis.
6.3. Création d’un système de classification révisé
Le rapport actuel tente de supprimer toute perception d’exclusivité dans la classification de la sécheresse oculaire en indiquant dans ce système que les diagnostics de sécheresse oculaire par déficience aqueuse et évaporative existent sous la forme d’un continuum plutôt que comme des entités séparées. Des éléments de chacune d’elles devraient être considérés pour le diagnostic [15] et la prise en charge [16].
Ce système de classification de la sécheresse oculaire comprend les éléments de classement pour apporter de la clarté dans le diagnostic du SSO (par le biais du rapport Méthodologie du diagnostic) [15], à partir duquel les différentes étiologies peuvent être considérées (se reporter au rapport Physiopathologie) [1] et un programme approprié de prise en charge peut être mis en place (se reporter au rapport Prise en charge et traitement) [16]. Une prise en charge appropriée des maladies de la surface oculaire associées à un diagnostic différentiel qui ressemblent à un SSO augmente les chances de réussite du traitement et permet de mettre en évidence et de prendre en charge convenablement tout élément coexistant de la maladie attribuable au SSO.
Il est recommandé d’entreprendre une sous-classification en se référant au rapport Physiopathologie du DEWS II de la TFOS [1], qui décrit la vaste gamme de sous-catégories possibles du SSO et fait référence à leur étiologie prédominante au sein du continuum des formes évaporative et par déficience aqueuse. Il est important de noter que d’après les preuves répertoriées dans les rapports du DEWS II de la TFOS, le système de classification prend également en compte les cas où les patients présentent des symptômes de sécheresse oculaire sans signes évidents ou présentent des signes marqués, mais sont dépourvus de symptômes de sécheresse oculaire [8, 17].
La Fig. 3 comporte un algorithme de décision clinique, établi d’après nos connaissances actuelles de la physiopathologie du SSO, qui cherche à favoriser la précision dans la classification de la présentation des SSO potentiels aux professionnels des soins de la vue.
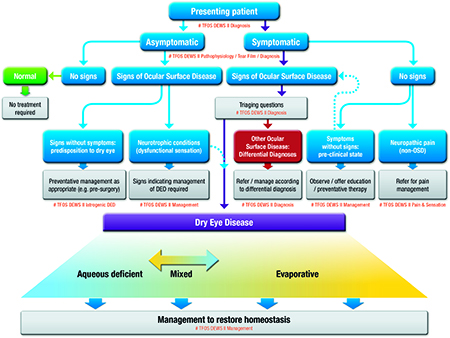
Fig. 3. Classification de la sécheresse oculaire (SSO). La partie supérieure de la figure représente un algorithme de décision clinique, commençant par l’évaluation des symptômes et suivi par l’examen des signes de maladie de la surface oculaire. Le SSO comporte à la fois des symptômes et des signes et peut se différencier des autres maladies de la surface oculaire grâce à l’utilisation de questions de catégorisation et de tests complémentaires [15]. C’est à ce groupe SSO que s’appliquent ce sous-typage diagnostique [15] et ces stratégies traditionnelles de prise en charge de la sécheresse oculaire [16]. Les patients présentant des symptômes sans signes cliniques démontrables n’entrent pas dans le groupe SSO mais sont répartis en maladie de la surface oculaire préclinique ou douleur neuropathique (maladie de surface non oculaire). À l’inverse, les patients asymptomatiques présentant des signes cliniques se répartissent en patients avec une sensibilité cornéenne faible et en patients avec des signes prodromiques qui risquent de développer un SSO manifeste avec le temps ou un facteur déclenchant, par exemple, après une intervention chirurgicale ophtalmique [17]. La partie inférieure de la Fig. 3 représente la classification étiologique du SSO et met en évidence les deux catégories prédominantes qui ne sont pas mutuellement exclusives, la sécheresse oculaire par déficience aqueuse (aqueous deficient dry eye, ADDE) et la sécheresse oculaire évaporative (evaporative dry eye, EDE) [4]. Les preuves épidémiologiques et cliniques suggèrent que la prépondérance du SSO est évaporative par nature [1, 9, 18], ce qui se reflète par une proportion plus importante d’EDE que d’ADDE dans la Fig. 3. Même s’il est possible que l’ADDE survienne sans signe évident d’EDE et vice versa, lorsque le SSO progresse, la probabilité que les caractéristiques de l’ADDE et de l’EDE deviennent évidentes augmente [14]. Une sous-classification supplémentaire de l’ADDE et de l’EDE n’est pas détaillée dans la Fig. 3, mais on sait qu’elle est liée à une large gamme de maladies, comme le décrit le rapport Physiopathologie [1]. L’ADDE correspond aux maladies affectant le fonctionnement des glandes lacrymales. L’EDE inclut à la fois les maladies liées aux paupières (par exemple le DGM ou en lien avec le clignement) et les causes associées à la surface oculaire (comme les maladies liées à la mucine ou aux lentilles de contact). Les détails physiopathologiques pour la répartition étiologique au-delà de la catégorisation en EDE ou en ADDE, sont plus amplement détaillés dans le rapport Physiopathologie du DEWS II de la TFOS [1] et le rapport Film lacrymal [5] . Les algorithmes de diagnostic et de prise en charge sont décrits dans leurs rapports respectifs du DEWS II de la TFOS [15,16].
7. Terminologie dans la classification du syndrome sec oculaire reviens
Comme pour la définition du SSO, une description détaillée de la terminologie est fournie pour clarifier la prise de décision à l’origine de la mise au point du système de classification. Dans la section suivante, des éléments spécifiques de la classification 2017 de la sécheresse oculaire (Fig. 3) sont présentés et décrits.
7.1. Syndrome de l’œil sec
Plus de vingt ans de recherche et d’innombrables visites de patients ont permis l’évolution de la compréhension du SSO. En conformité avec la définition, la classification du SSO reconnaît la nécessité de la prise en compte des symptômes et de la présence de signes associés au niveau de la surface oculaire dans la formulation d’un diagnostic de SSO. Dans le système de classification présenté ici, une distinction est établie entre le SSO et les autres maladies de la surface oculaire, ainsi que des cas dans lesquels il y a des symptômes, mais pas de signes, ou des signes, mais pas de symptômes.
7.2. Diagnostics différentiels d’autres maladies de la surface oculaire
La maladie de la surface oculaire est une catégorie vaste. On considère qu’elle inclut une multitude de troubles de la surface oculaire, dont certains ressemblent fortement au SSO, et dont un grand nombre survient en même que temps que celui-ci [15]. En raison de cette complexité et de ce chevauchement, la sécheresse oculaire est fréquemment diagnostiquée par exclusion. Le rapport Méthodologie du diagnostic du DEWS II de la TFOS présente des « questions de catégorisation » [15], qui peuvent être utilisées en association avec des résultats cliniques, pour émettre un diagnostic différentiel par rapport à d’autres troubles de la surface oculaire et parvenir à soulager des signes et des symptômes qui sans cela pourraient être attribués au SSO.
Il est important de noter que de nombreuses maladies de la surface oculaire peuvent correspondre à des comorbidités de la sécheresse oculaire. C’est pourquoi une approche progressive pour la prise en charge, avec un suivi ultérieur destiné à surveiller les signes et les symptômes, est justifiée. Par exemple, les symptômes et les changements du film lacrymal proportionnels au SSO peuvent tout à fait survenir dans une maladie telle qu’une lagophtalmie, due à la mauvaise juxtaposition de la paupière sur le globe oculaire, empêchant la formation d’un film lacrymal stable entre les clignements. Pourtant, il est peu probable qu’un traitement pour la sécheresse oculaire seul réussisse, car le problème relatif à la surface ne peut se résoudre sans la prise en charge de la lagophtalmie. À l’inverse, restaurer la juxtaposition paupière-globe oculaire grâce à une intervention chirurgicale pour la prise en charge de la lagophtalmie peut totalement supprimer les symptômes et signes de la sécheresse oculaire sans avoir besoin d’utiliser des traitements pour celle-ci [16, 19]. Il faudra effectuer d’autres recherches sur les maladies de la surface oculaire en tant que comorbidités induisant une sécheresse oculaire « secondaire ».
7.3. Les symptômes sans signes : la douleur neuropathique
Le rapport de la sous-commission Douleur et sensations décrit un scénario clinique de douleur neuropathique due à une lésion ou à une maladie du système somato-sensoriel, dans lequel les symptômes de douleur oculaire l’emportent de façon disproportionnée sur les signes cliniques [8]. Il s’agit d’une distinction importante dans le diagnostic. La prise en charge nécessaire de la douleur sort du cadre du traitement du SSO [8].
7.4. Les symptômes sans les signes : état préclinique de sécheresse oculaire
On admet de plus en plus que des symptômes correspondant au SSO, mais en l’absence de signes cliniques et plus particulièrement lorsque les symptômes sont intermittents, puissent indiquer un état préclinique de sécheresse oculaire, ou un scénario d’apparition de sécheresse oculaire épisodique. Une évaluation du développement des signes et le contrôle des symptômes par la sensibilisation et la prévention sont suggérés. Des études évaluant l’histoire naturelle des efforts préventifs à court et à long terme dans ce groupe de patients sont nécessaires [9]. Il serait également nécessaire d’évaluer plus en profondeur si ces individus présentent un risque plus élevé de développer un SSO iatrogène par rapport aux personnes asymptomatiques [17].
7.5. Les signes sans les symptômes : la sensibilité cornéenne réduite
Les patients présentant des signes de maladie de la surface oculaire, mais ne signalant aucun symptôme de gêne, nécessitent une réflexion pour décider si une prise en charge de la sécheresse oculaire est indiquée. Les lésions des nerfs de la cornée consécutives à un SSO de longue durée sont un phénomène reconnu et la sensibilité cornéenne réduite peut masquer une gêne. La sensation de dysfonctionnement est une fonction du processus sous-jacent de la maladie. Il existe d’autres formes de maladies de la cornée, dans lesquelles la sensation cornéenne est réduite. Celles-ci doivent également être prises en charge de façon adaptée [17].
7.6. Les signes sans les symptômes : prédisposition à la sécheresse oculaire
Des changements de la surface oculaire en l’absence de symptômes peuvent être remarqués au cours d’un examen préopératoire pour la cataracte ou la chirurgie réfractive par exemple et peuvent indiquer un stade précoce de la maladie susceptible d’entraîner chez le patient le risque de développer un SSO symptomatique après l’intervention chirurgicale [17]. Une prise en charge préventive doit être envisagée, comme le décrit plus en détail le rapport iatrogène [17]. Récemment, un DGM asymptomatique a été rapporté avec une prévalence double du DGM symptomatique dans une population caucasienne [20]. Même s’il existe des données limitées sur l’histoire naturelle du SSO, les symptômes deviennent plus courants avec l’âge [9] et les individus atteints de DGM ont une plus forte probabilité de signaler une augmentation de la gravité de leurs symptômes avec le temps [21]. Tous ces arguments peuvent être en faveur d’une intervention.
8. Classification du syndrome sec oculaire d’après l’étiologie prédominante reviens
Le système de classification de la Fig. 3 (moitié inférieure) représente un schéma basé sur les étiologies prédominantes, bien que souvent chevauchantes, de la sécheresse oculaire évaporative et par déficience aqueuse. L’EDE occupe une surface plus importante que l’ADDE sur le schéma en raison des éléments actuels indiquant que la composante évaporative du SSO est plus courante que la composante par déficience aqueuse [14, 18]. En effet, le DGM, qui contribue à l’EDE, est considéré comme la cause principale de la sécheresse oculaire dans des études basées sur la clinique et la population [18, 22, 23]. La densité de la coloration aux extrémités du carré indique que dans certains cas, un ADDE peut survenir sans EDE observable et vice versa. Toutefois on sait que lorsque la maladie évolue, il est plus probable que les deux composantes apparaissent cliniquement. La déficience aqueuse correspond à des troubles affectant les glandes lacrymales, alors que la sécheresse oculaire évaporative est associée à des troubles liés aux paupières (par exemple DGM et anomalies du clignement) ou à la surface oculaire (comme les maladies liées à la mucine ou aux lentilles de contact). Une répartition étiologique plus précise est décrite en détail dans le rapport Physiopathologie [1]. Dans l’approche de prise en charge pour restaurer le film lacrymal et l’homéostasie de la surface oculaire, la catégorie prédominante (étiologie) aide à décider de la démarche thérapeutique principale [4], même s’il demeure important que tous les aspects soient pris en compte lors de la détermination de la combinaison la plus probable d’éléments responsables propres à chaque patient atteint de SSO, afin de mieux cibler la stratégie thérapeutique appropriée.
9. Orientations futures reviens
La définition et la classification du SSO ont considérablement évolué ces 20 dernières années, essentiellement grâce à une meilleure compréhension de la physiopathologie de la maladie. Le SSO pourrait être encore mieux compris grâce à la poursuite des recherches, y compris avec l’analyse prospective de l’étude de l’histoire naturelle de la sécheresse oculaire, notamment le SSO traité ou non traité pour chacun des principaux sous-types de la maladie et les cas pour lesquels les symptômes ou les signes cliniques sont absents, ainsi qu’une compréhension plus détaillée de la relation existant entre le SSO et d’autres troubles chevauchants ou ressemblants. Le domaine a évolué considérablement durant cette période et les dix prochaines années promettent d’être aussi remarquables pour la génération suivante de cliniciens et scientifiques spécialistes de la sécheresse oculaire.
10. Informations financières reviens
J. P. Craig, vice-président : Oculeve, Allergan, Manuka Health NZ, ESwin, CooperVision, Alcon, Optima Pharmaceuticals, OPSM NZ, Akorn, Medmont (F) ; Carl Zeiss Meditec, Eye Institute Auckland (C).
K. K. Nichols : Allergan, Bruder Healthcare Company (conjoint) Eleven Biotherapeutics, Johnson and Johnson Vision Care (conjoint), Kala, Oculus, Sarcode/Shire, TearScience (F) ; Alcon, Allergan, Bausch & Lomb/Valeant, Eleven Biotherapeutics, Kala, Insite Pharma, Parion, Sarcode/Shire, ScienceBased Health, Santen, Tearful Innovations (C) ; Shire (conjoint) (R).
J. Nichols : Johnson and Johnson Vision Care (F) ; Bruder Healthcare Company (F) ; Alcon (conjoint), Allergan (conjoint), Eleven Biotherapeutics (conjoint), Kala, Oculus (conjoint), Sarcode/Shire (conjoint), TearScience (conjoint), (F) ; Alcon (conjoint), Allergan (conjoint), Bausch & Lomb/Valeant (conjoint), Eleven Biotherapeutics (conjoint), Kala (conjoint), Insite Pharma (conjoint), Parion (conjoint), Sarcode/Shire (conjoint), ScienceBased Health (conjoint), Santen (conjoint), Tearful Innovations (conjoint), (C) ; Shire (R).
B. Caffery : Allergan (F) ; Allergan, Labtician (C) ; Allergan (R).
H. Dua : Novartis (F) ; GlaxoSmithKline (I) ; Nicox, Théa, Allergan (C) ; NuVision (P) ; Alcon, Allergan, Bausch & Lomb, Nicox, Théa ; NuVision (S).
E. Akpek : Allergan (F) ; Biogen, Seattle Genetics, GSK, Nicox (C).
K. Tsubota : Dai Nippon Insatsu, Echo Denki, JIN Co, Ltd., Kowa Co. Ltd., MediProduct, Inc., Molecular Physiology Chemistry Laboratory, Inc., Novartis Pharma K.K., Oryza Oil & Fat Chemical Co., Ltd., Santen Pharmaceutical Co., Ltd., Toshiba Materials Co., Ltd., WAKASA SEIKATSU Corp. (F) ; QOV, Inc., Tear Solutions, Tissue Tech Inc., Tsubota Laboratory, Inc. (I) ; Laboratoires Théa, Novaliq GmbH, SIFI, SpA (C) ; Functional Visual Acuity Meter, Moisture Glasses, Menisometry Strips, Vitamin D Ointment (P) ; AMO Japan K.K. ; NIDEK Co. Ltd., Otsuka Pharmaceutical Co Ltd ; Santen Pharmaceutical Co., Ltd. (R) ; Ocular Surface Research & Education Foundation (conseil d’administration) ; Qualities Inc., (conseil consultatif) ; TearSolutions (conseil consultatif) ; Yolia Health (conseil consultatif) ; Metro Biotech (conseil consultatif) ; Nobel Institute of Medical Science ; (société du conjoint) (S).
C-K. Joo : N.
Z. Liu : Reilin Co. (C) ; Santen, Reilin, Alcon (R).
J. D. Nelson, Chair : TearSolutions (I, C, R), Santen (F, C), rédacteur en chef, Ocular Surface (Surface oculaire) (F).
F. Stapleton : Alcon Laboratories, Allergan, CooperVision, Johnson & Johnson Vision Care, Stilted (F) ; Nidek (C).
F (soutien financier), I (intérêt financier personnel), E (emploi), C (consultant), P (brevet), R (bénéficiaire), N (sans relation commerciale), S (non rémunérateur).
11. Remerciements reviens
Les auteurs expriment leur gratitude pour les contributions supplémentaires d’Antony J. Bron, Gary N. Foulks, Lyndon Jones, James S. Wolffsohn et Mark D.P. Wilcox dans l’amélioration de la définition et à Nino Longo (Catania, Itale) et Sabrina Zappa (Rome, Italie) pour leur aide dans l’illustration de la Fig. 3.
12. Références reviens
[1] Bron AJ, dePaiva CS, Chauhan SK, Bonini S, Gabison EE, Jain S, et al. TFOS DEWS II Pathophysiology report. Ocul Surf 2017;15:438–510.
[2] Lemp MA. Report of the national eye institute/industry workshop on clinical trials in dry eyes. CLAO J 1995;21(4):221–232.
[3] Behrens A, Doyle JJ, Stern L, Chuck RS, McDonnell PJ, Azar DT, et al. Dysfunctional tear syndrome: a Delphi approach to treatment recommendations. Cornea 2006;25(8):900–907.
[4] The definition and classification of dry eye disease: report of the Definition and Classification Subcommittee of the International Dry Eye WorkShop. Ocul Surf 2007;2007(5):75–92.
[5] Willcox MDP, Argüeso P, Georgiev G, Holopainen J, Laurie G, Millar T, et al. TFOS DEWS II Tear Film report. Ocul Surf 2017;15:366–403.
[6] Baudouin C. A new approach for better comprehension of diseases of the ocular surface. J Fr Ophtalmol 2007;30:239–246.
[7] Baudouin C, Messmer EM, Aragona P, Geerling G, Akova YA, Benítez-del-Castillo J, et al. Revisiting the vicious circle of dry eye disease: a focus on the pathophysiology of meibomian gland dysfunction. Br J Ophthalmol 2016;100(3):300–306.
[8] Belmonte C, Nichols JJ, Cox SM, Brock JA, Begley CG, Bereiter DA, et al. TFOS DEWS II pain and sensation report. Ocul Surf 2017;15:404–437.
[9] Stapleton F, Alves M, Bunya VY, Jalbert I, Lekhanont K, Malet F, et al. TFOS DEWS II Epidemiology report. Ocul Surf 2017;15:334–365.
[10] Nichols JJ, Willcox MD, Bron AJ, Belmonte C, Ciolino JB, Craig JP, et al. The TFOS international workshop on contact lens discomfort: executive summary. Invest Ophthalmol Vis Sci 2013;54:TFOS7–TFOS13.
[11] Nelson JD, Shimazaki J, Benitez-del-Castillo JM, Craig JP, McCulley JP, Den S, et al. The international workshop on meibomian gland dysfunction: report of the definition and classification subcommittee. Invest Ophthalmol Vis Sci 2011;52(4):1930–1937.
[12] Merriam-Webster Dictionary 2016. https://www.merriam-webster.com.
[13] Chao C, Golebiowski B, Cui Y, Stapleton F. Development of a Chinese version of the ocular comfort index. Invest Ophthalmol Vis Sci 2014;55(6):3562–3571.
[14] Shimazaki J, Goto E, Ono M, Shimmura S, Tsubota K. Meibomian gland dysfunction in patients with Sjögren syndrome. Ophthalmology 1998;105(8):1485–1488.
[15] Wolffsohn JS, Arita R, Chalmers R, Djalilian A, Dogru M, Dumbleton K, et al. TFOS DEWS II Diagnostic Methodology report. Ocul Surf 2017;15:539–574.
[16] Jones L, Downie LE, Korb D, Benitez-del-Castillo JM, Dana R, Deng SX, et al. TFOS DEWS II Management and Therapy report. Ocul Surf 2017;15:575–628.
[17] Gomes JAP, Azar DT, Baudouin C, Efron N, Hirayama M, Horwath-Winter J, et al. TFOS DEWS II Iatrogenic report. Ocul Surf 2017;15:511–538.
[18] Lemp MA, Crews LA, Bron AJ, Foulks GN, Sullivan BD. Distribution of aqueous-deficient and evaporative dry eye in a clinic-based patient cohort: a retrospective study. Cornea 2012;31(5):472–478.
[19] Latkany RL, Lock B, Speaker M. Nocturnal lagophthalmos: an overview and classification. Ocul Surf 2006;4(1):44–53.
[20] Viso E, Rodríguez-Ares MT, Abelenda D, Oubiña B, Gude F. Prevalence of asymptomatic and symptomatic meibomian gland dysfunction in the general population of Spain. Invest Ophthalmol Vis Sci 2012;53(6):2601–2606.
[21] Lienert JP, Tarko L, Uchino M, Christen WG, Schaumberg DA. Long-term natural history of dry eye disease from the Patient's perspective. Ophthalmology 2016;123(2):425–433.
[22] Viso E, Gude F, Rodríguez-Ares MT. The association of meibomian gland dysfunction and other common ocular diseases with dry eye: a population-based study in Spain. Cornea 2011;30(1):1–6.
[23] Tong L, Chaurasia SS, Mehta JS, Beuerman RW. Screening for meibomian gland disease: its relation to dry eye subtypes and symptoms in a tertiary referral clinic in Singapore. Invest Ophthalmol Vis Sci 2010;51:3449–3454.